Заморозити на бігу. Нобелівка з хімії зможе допомогти перемогти рак

У середу, 4 жовтня, Шведська королівська академія наук оголосила лауреатів Нобелівської премії з хімії за 2017 р. Премію отримали Жак Дюбоше, Йоахім Франк і Річард Хендерсон з формулюванням "за розвиток криоэлектронной мікроскопії високої роздільної здатності для визначення структури біомолекул в розчині".
Жак Дюбоше - швейцарський біофізик з Університету Лозанни, Йоахім Франк - професор Університету Колумбії (США), Річард Хендерсон працює в лабораторії молекулярної біології в Кембриджі (Великобританія). Примітно, що співробітники останньої десять разів ставали нобелівськими лауреатами, а в цілому Університет Кембриджу може похвалитися 97 нобелівськими лауреатами - абсолютний рекорд серед внз світу.
Відразу після оголошення переможців Йоахім Франк підкреслив, що метод криоэлектронной мікроскопії - прорив в молекулярній медицині. Адже сьогодні вчені можуть спостерігати не тільки за роботою цілих органів і клітин, але і вивчати будову і функціонування окремих молекул.
Нобелівський комітет у своєму рішенні зазначив, що багато ключові наукові відкриття вдалося здійснити саме завдяки розвитку техніки - вчені часто не могли підтвердити свої припущення просто тому, що не існувало необхідних приладів. Зокрема, від таких білих плям страждали біохіміки. Криоэлектронная мікроскопія все змінила: сьогодні вчені можуть візуалізувати процеси, ключові для розуміння хімії життя, так і для створення ліків.
Сама техніка полягає в спостереженні за речовинами, наприклад, білками, в їх природному середовищі в трьох вимірах. "Це дозволяє точно оцінити структуру кожної молекули (на рівні атома), а також відстежувати, як рухаються елементи білка, як вони з'єднуються один з одним, створюють комплекси і взаємодіють", - зазначила голова Нобелівського комітету з хімії Сара Сногеруп Линсе. Причому можна спостерігати за будь-яким атомом, який знаходиться в клітині живого організму, не пошкоджуючи при цьому саму клітину. Так, за допомогою цього методу вдалося детально вивчити будову вірусу Зіку, що стало ключовим для розробки лікування.
Саме завдяки новим Нобелівським лауреатам сучасні вчені можуть заглянути всередину молекули.
Заморозити клітку
Біохіміки довгі роки мріяли про те, щоб спостерігати за молекулами в їх середовищі без фарбування або будь-якої фіксації хімічними речовинами. Зокрема, зразки пробували заморожувати, але з'являються в процесі заморожування кристали спотворювали молекули.
Близько 30 років тому Річард Хендерсон почав вивчати білки за допомогою класичної рентгенівської кристалографії. Проте незабаром зрозумів, що цей метод має значні обмеження. Тоді Хендерсон вирішив використовувати електронний мікроскоп, хоча цю техніку зазвичай застосовували для вивчення вже мертвих тканин - біологічні зразки руйнувалися під дією електронів. У 1990-му Хендерсону завдяки електронному мікроскопу вдалося створити модель білка - бактериородопсина - у високому дозволі. Це доводило, що електронний мікроскоп можна використовувати і в біології, тільки потрібно було придумати, як підготувати зразки.
Цим питанням зайнявся Жак Дюбоше. Зразки для електронного мікроскопа повинні перебувати у вакуумі, але у вакуумі вода випаровується, що призводить до руйнування біомолекул. На початку 1980-х Дюбоше вирішив прибрати випаровування, просто заморозивши воду. Він охолоджував зразки при температурі нижче 200 градусів, так що вода застигала навколо зразка, наче шкаралупа. Вона переходила з рідкого в стеклоподобное стан без утворення кристалів льоду. Таким чином, молекули могли зберігати свою природну форму. Багато дослідники стверджували, що із задуму Дюбоше нічого не вийде - не можна, мовляв, остекловать краплю води. Однак у 1982 р. Дюбоше вперше застосував свій метод, а в 1984-му опублікував перші криоэлектронные зображення вірусів.
Однак при цьому якість зображення було невисоким. У 1991-му Йоахім Франк створив 3D-зображення рибосом (використовуючи метод склування Жака Дюбоше) з роздільною здатністю 40 Ангстремов. Ангстрем - одна десята нанометра - набагато більше розміру атома. Незважаючи на те що на картинці було видно лише контури рибосоми, робота Франка стала серйозним кроком вперед.
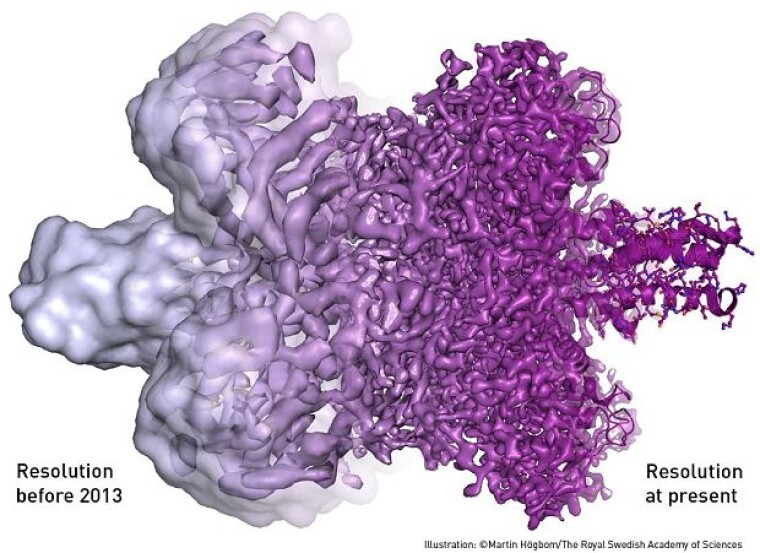
З того часу розвиток технології криоэлектронной мікроскопії йде семимильними кроками. Сьогодні вчені не можуть просто заглянути всередину молекули, але і побачити її в 3D-форматі, змоделювати її поведінку. Ілюстрацією цього може служити зображення ензиму бета-галактозидази, сполученого з іншою молекулою. З лівого боку - знімок, зроблений кілька років тому, з правого - знімок, зроблений сучасним мікроскопом.
Примітно, що Нобелівську премію вже двічі присуджували за дослідження, проведені за допомогою криоэлектронной мікроскопії. Так, в 2009-му за дослідження структури і функції рибосоми, зчитує інформацію з ДНК і синтезує білки, премії з хімії удостоїлися Векатраман Рамакришнан з Кембриджа, Томас Стайц з Єльського університету (США) і Ада Йонат з Інституту Вейцмана (Ізраїль). А в минулому році Нобелівську премію одержали Жан-П'єр Соваж, Бернард Феринга і Фрезер Стоддарт "за проектування і синтез молекулярних машин".
Перемогти діабет і рак
Головна цінність методу в тому, що вчені можуть спостерігати за поведінкою молекул в їх природному середовищі, а це ключові процеси як для розуміння хімії життя, так і для створення ліків. Так, зокрема, саме завдяки методу, придуманому свіжоспеченими нобелівськими лауреатами, вдалося вивчити структуру білків, які викликають стійкість до антибіотиків, білкових комплексів, що регулюють біологічні годинники (за вивчення цього феномену в цьому році теж вручили Нобелівську премію), білкового "датчика тиску", який дозволяє нам чути, і навіть вірусу Зіку. Дані спостережень за миторибосомальными білками вже дозволили вченим пояснити побічні дії декількох класів ліків. І з'ясувати, як змінити структуру медпрепаратів, щоб уникнути шкідливих наслідків.
"Розуміння нашої імунної системи - ключовий фактор у боротьбі з раком, інфекційними захворюваннями, наприклад малярією, і аутоімунними захворюваннями, включаючи діабет і розсіяний склероз. Ключем до розуміння і лікування цих захворювань є знання того, як протеїни і клітини взаємодіють на молекулярному рівні", - заявив професор Джеймс Уиссток з університету Монаша (Мельбурн, Австралія) на відкритті лабораторії з криоэлектронным мікроскопом у своєму вузі. Він впевнений, що саме така техніка допоможе вивчити механізми виникнення раку різних типів, діабету і розсіяного склерозу, і на підставі отриманої інформації розробити ліки від цих хвороб.
Нобелівка з хімії: історія нагород
Лише один вчений двічі отримав Нобелівську премію в галузі хімії: Фредерік Сенгер у 1958 р. був нагороджений за "дослідження структури білків, особливо інсуліну", а в 1980-му отримав премію за "внесок у встановленні основних послідовностей нуклеїнових кислотах".
Середній вік лауреата Нобелівської премії з хімії - 58 років. Найстарший - Джон Фенн, якого в 2002-му нагородили за розробку мас-спектрометричного методу дослідження біологічних макромолекул. Дослідження Фенн почав у віці 70 років, премію отримав 85. Наймолодшим лауреатом став Фредерік Жоліо, який був нагороджений у віці 35 років за синтез нових радіоактивних елементів. Премію він отримав разом з дружиною Ірен Жоліо-Кюрі, дочкою знаменитої дворазової нобелівської лауреатки (з хімії та фізики) Марії Склодовської-Кюрі.
За весь час існування премії лише чотири жінки отримували нагороди в області хімії. Разом з Ірен Жоліо-Кюрі слід згадати її матір Марію Склодовську-Кюрі (була нагороджена в 1911-му "за видатні заслуги в розвитку хімії, відкриття елементів радію і полонію, виділення радію і вивчення природи і сполук цього елемента"), Дороті Кроуфут Годжкин ( у 1964 р. за визначення за допомогою рентгенівських променів структур біологічно активних речовин) і Ада Йонат (у 2009-му за дослідження структури і функції рибосоми).
Найчастіше Нобелівська премія з хімії присуджується в області біохімії (близько 50 нагород).