Новые тайны генома. Как бактерия-убийца спасает человечество от вымирания
Накопление патогенных мутаций может привести к генетическому вырождению и затем вымиранию человечества. Новое открытие поможет нам избежать такой участи

Журнал Science сообщил об уникальном методе, который изобрел профессор Гарвардского университета Дэвид Лю – один из главных специалистов в мире по редактированию генома. Новая технология открывает путь к лечению митохондриальных болезней – это целая группа наследственных заболеваний, связанных с дефектами в функционировании митохондрий. Но прежде чем рассказывать об этой технологии и ее значении для медицины, нужно, конечно, напомнить, что такое митохондрии и какую роль они играют в наших клетках.
Живые электростанции
Митохондрии есть практически во всех клетках нашего организма. Их особенно много в клетках, у которых велика потребность в энергии. В каждой клетке таких наших органов, как мозг, сердце, мышцы, содержатся сотни и даже тысячи митохондрий. Митохондрии умеют использовать кислород для генерации энергии. Поэтому их называют электростанциями клетки.
По своему происхождению это бактерии, возникшие очень давно – около 2 млрд лет назад. Вскоре они были захвачены клетками, не умеющими самостоятельно генерировать энергию из кислорода. Став составной частью клетки, эти бактерии сохранили собственный геном.
Для нас немаловажно, что ДНК митохондрий наследуются исключительно по материнской линии. Как известно, оплодотворение заключается в слиянии мужского сперматозоида и женской яйцеклетки. При этом образуется зигота – первичная клетка нового живого существа. Ее ядро – это слившиеся ядра сперматозоида и яйцеклетки. Но сперматозоид не переносит в зиготу отцовские митохондрии. Поэтому все митохондрии в ней – от материнской яйцеклетки.
Родительские риски
Вместе с митохондриями передаются от матерей детям (и девочкам, и мальчикам) митохондриальные болезни. В митохондриальной ДНК известно уже более 300 различных мутаций. Тяжесть митохондриальных болезней варьируется из поколения в поколение, но общее правило заключается в том, что все они неумолимо прогрессируют с возрастом.
В последнее время появляется все больше свидетельств патологии митохондрий при взрослых дегенеративных заболеваниях, таких как болезнь Паркинсона, болезнь Альцгеймера, а также при сахарном диабете, ожирении, шизофрении, раке. Но все же традиционно митохондриальными болезнями называют патологии, непосредственно связанные с нарушением энергетической функции митохондрий.
В митохондриях происходит синтез 95% клеточной энергии, идущей на поддержание жизни и роста организма. Когда митохондрии не работают, в клетке вырабатывается все меньше и меньше энергии, что приводит к нарушению ее функции. От митохондриальных болезней страдают больше всего клетки головного мозга, скелетной мускулатуры, сердца, печени, почек, эндокринной и дыхательной систем.
Митохондриальные болезни могут начать проявляться практически в любом возрасте. Более того, недавно были описаны случаи митохондриальных болезней, начинающихся еще внутриутробно и приводящих к развитию пороков головного мозга. Но подавляющее большинство митохондриальных болезней начинаются в детском возрасте. В зависимости от того, какие клетки поражены в большей степени, симптомы могут включать отставание в росте и развитии, поражение нервной системы, эпилептические приступы, нарушение зрения и/или слуха, мышечную слабость, утомляемость, нарушение дыхания и сердечного ритма, печеночную недостаточность, желудочно-кишечные нарушения, различные эндокринные заболевания (диабет, гипопаратиреоз).
Еще в 2008 г. в Ньюкаслском университете (Англия) провели исследование с целью оценить распространенность мутаций митохондриальной ДНК. Для этого ученые проанализировали образцы неонатальной пуповинной крови от 3168 новорожденных – и в 15 случаях обнаружили патогенные митохондриальные мутации. Авторы исследования пришли к выводу: "По крайней мере один из 200 здоровых людей несет патогенную мутацию митохондриальной ДНК, которая потенциально вызывает болезнь у потомков женщин-носителей".
Два подхода
Точные молекулярно-генетические доказательства митохондриальной природы ряда заболеваний были получены еще в 1980-х. Однако способов их лечения тогда было не видно. Также было совершенно непонятно, как можно помочь женщинам, которые из-за этих болезней не могут или боятся иметь детей.
Но в XXI в. решения начали вырисовываться. Правда, лечение митохондриальных болезней у взрослых все еще остается делом неблизкого будущего. Ведь даже обычная генная терапия только-только начинает входить в клиническую практику. А исправить дефекты ДНК в митохондриях клеток (хотя бы в каком-то одном органе) – это на порядок более сложная задача, чем отредактировать гены, находящиеся в клеточных ядрах.
Прежде чем браться за лечение взрослых, можно было искать варианты, как предотвратить митохондриальные болезни у будущих детей. То есть как избежать передачи патогенных мутаций митохондриальной ДНК по наследству.
Поскольку проблема кроется в митохондриях, то можно было подступать к ней с двух сторон: во-первых, менять больные митохондрии на здоровые; во-вторых, лечить больные митохондрии. Усилиями ученых разных стран поиск велся в обоих направлениях.
Варианты с "третьим родителем"
Более простым в реализации оказался первый способ. Эффективная технология замены больных митохондрий на здоровые уже найдена. Это – митохондриальная заместительная терапия (МЗТ), которая уже вошла в клиническую практику некоторых стран, в том числе Украины.
Существуют два метода МЗТ. Различаются они способом получения эмбриона. В обоих методах, когда эмбрион получен, его помещают в матку матери для вынашивания, как при обычной процедуре экстракорпорального оплодотворения.
Первый метод МЗТ состоит в том, что ядро яйцеклетки матери пересаживают в донорскую яйцеклетку с предварительно удаленным ядром, после чего оплодотворяют ее спермой отца. Таким образом, от матери будущему ребенку передаются гены, содержащиеся в ядре ее яйцеклетки, от отца – гены, содержащиеся в сперматозоиде, а от донорской яйцеклетки – гены, содержащиеся в ее митохондриях.
Чжан начинал свои опыты на своей родине – в Китае. Но их запретили тамошние регуляторные органы, мотивируя это подозрительной близостью исследований Чжана к клонированию человека, а оно в Китае запрещено. Впрочем, в США, куда перебрался Чжан, возможности тоже были ограничены. FDA (Администрация продовольствия и лекарств) требовала от репродуктивных клиник считать использование донорских яйцеклеток экспериментальной процедурой и получать на них специальное разрешение.
Поэтому своей цели Чжан достиг в Мексике, где власти регулированием деторождения не столь озабочены. О своей работе сотрудники клиники New Hope рассказали в октябре 2016 г. на ежегодном слете Американского общества репродуктивной медицины в Солт-Лейк-Сити. Они сообщили, что мальчику исполнилось три месяца, он здоров и развивается нормально. Тем не менее "эксперты по биоэтике" не замедлили раскритиковать их. Одни обвинили врачей в экспериментах на живых людях, другие указывали на недостаток данных об эффективности и безопасности этой процедуры для ребенка и его будущего потомства. Клинический директор New Hope Алехандро Чавес-Бадиола в ответ подчеркивал, что в Мексике нет законов, запрещающих МЗТ, и что эксперимент его клиники получил одобрение этического комитета. Итог скандала был предсказуем: в марте 2018 г. FDA укрепила возведенную прежде "бумажную стену" и запретила любые манипуляции по замещению митохондрий.
Второй метод МЗТ развивается в Европе. Он заключается в том, что сначала материнскую яйцеклетку с дефектными митохондриями оплодотворяют, а затем извлекают из нее ядро, уже содержащее ДНК обоих родителей, и переносят в лишенную ядра донорскую яйцеклетку. Этот метод называется пронуклеарным переносом.
Еще с 2016 г. его осваивают украинские врачи. В январе 2017 г. киевские репродуктологи заявили о рождении у них первого в мире ребенка после пронуклеарного переноса. Подчеркнем, что их работа была одобрена этическим советом Украинской ассоциации репродуктивной медицины. Законодательно эти вопросы в Украине пока не урегулированы.
Единственная страна в мире, где манипуляции по замещению митохондрий сейчас официально одобрены, – это Великобритания. В феврале 2015 г. обе палаты британского парламента утвердили поправки в закон о работе с эмбрионами, разрешающие донорство митохондрий при экстракорпоральном оплодотворении. Впрочем, чтобы получить лицензию на такие процедуры, нужно пройти долгие обсуждения в кабинетах Управления по оплодотворению человека и эмбриологии.
В марте 2017 г. (вскоре после успеха киевлян) первую в Великобритании лицензию на рождение детей с использованием метода пронуклеарного переноса получила группа врачей из Ньюкасла, которую возглавляет профессор репродуктивной биологии Мэри Герберт. Врачи подчеркнули, что они довольны решением "помочь семьям, пострадавшим от этих разрушительных заболеваний". Сообщая об этом, агентство Reuters не преминуло упомянуть и позицию критиков, заявивших, что это "опасный шаг, который приведет к созданию генетически модифицированных дизайнерских младенцев".
Неэтичная биоэтика
Как видим, методы МЗТ уже освоены на практике, по крайней мере, в нескольких клиниках в разных странах мира. Митохондриальные болезни могли бы стать первыми генетическими болезнями, которые люди научились лечить массово (ибо МЗТ обходится без генной терапии и проще нее). Но этого не произошло. А все потому, что к методам МЗТ прочно приклеилось название "ребенок от трех родителей". И пусть исследователи считают его некорректным (от донорских митохондрий поступает всего 37 генов, а от отца и матери их по 20 тыс.), но оно благодаря "экспертам по биоэтике" (которых можно самих обвинить в этической нечистоплотности) теперь устойчиво ассоциируется с нарушением этических норм.
Поэтому, чтобы решить проблему бесплодия или избавить своего будущего ребенка от риска стать обладателем целого букета неизлечимых болезней, родителям приходится отправляться в "эмбриологические турне", иногда на другой край света. В свою очередь, сама эта технология по тем же причинам тормозится в развитии. Желающим экспериментировать с яйцеклетками и их митохондриями приходится искать себе страну, где за это не закидают камнями – ни буквально (на улице), ни фигурально (в медиа).
Генная терапия от Дэвида Лю
В этих условиях новые надежды дает альтернативный подход, предлагающий лечить больные митохондрии, а не менять их на здоровые донорские. Он не требует никакого "третьего родителя" и нисколько не напоминает клонирование. Конечно, это не значит, что у него есть шансы избежать остракизма со стороны "экспертов по биоэтике". Но все же можно надеяться на то, что он не вызовет столь сильных предубеждений в общественном мнении.
Проблема этого подхода в том, что редактировать гены в митохондриях еще труднее, чем в ядре клетки. В 2013-м одним из главных научных прорывов года стала технология CRISPR. Она позволяет исправлять дефектные гены в живом организме: для этого нужно впрыснуть в кровь систему редактирования, и та будет чинить генетические поломки прямо в работающих тканях. Но против митохондриальных мутаций этот метод бессилен. Дело в том, что ключевой компонент редактора CRISPR чересчур велик для проникновения в митохондрии. То есть вместо починки получается разрушение.
Решить эту проблему взялась группа Дэвида Лю в сотрудничестве с двумя другими исследовательскими группами. И вот в июле 2020 г. в журнале Nature вышла статья, где Лю и его соавторы рассказали о созданной ими технологии митохондриальной генной терапии. Ей посвятили большие публикации журнал Science и ряд других изданий.
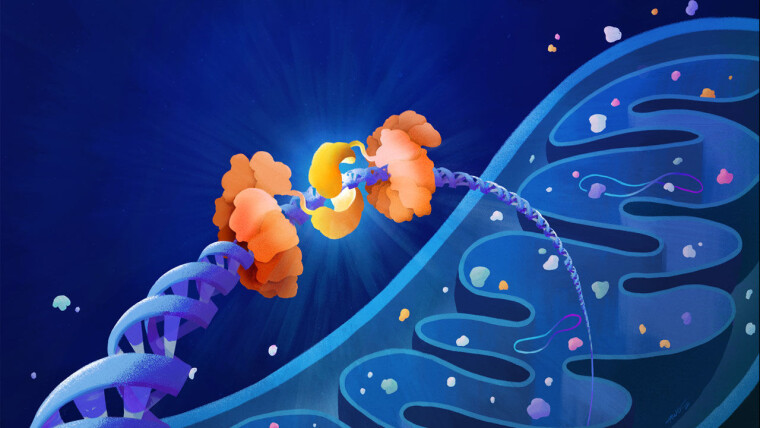
Не будем злоупотреблять техническими подробностями. Но отметим, что эта технология построена на основе фермента, выделяемого бактерией Burkholderia cenocepacиa. То есть ученые в поисках работоспособного решения в конце концов воспользовались методом, который давно изобрели бактерии.
Как пояснил медицинский сайт STAT, бактерии ведут против других бактерий химическую войну. Химическое оружие, используемое бактериями Burkholderia cenocepacia, представляет собой фермент, который проникает во вражескую бактерию и убивает ее с восхитительной простотой: он осуществляет в ее ДНК точечные мутации. Точечная мутация заключается в том, что одно основание ДНК (аденин, цитозин, тимин или гуанин) заменяется другим. Именно это и делает фермент: он заменяет на каком-то участке вражеской ДНК правильное основание на неправильное.
Генетические дефекты, ведущие к митохондриальным болезням, зачастую вызваны как раз такими точечными мутациями. И ученые осознали, что этот фермент с тем же успехом можно использовать для исправления мутаций. Если подвести его к мутировавшему участку ДНК митохондрии, то он исправит неправильное основание на правильное. Так фермент-убийца, используемый Burkholderia cenocepacia против вражеских бактерий, стал в руках ученых ферментом-исцелителем, используемым для исправления мутаций в митохондриях.
Защита от вымирания
Конечно, ученым пришлось решить множество проблем. В частности, они сумели найти способ, как доставить фермент-исцелитель точно к тому участку ДНК митохондрии, который мутировал.
Разработчикам митохондриальной генной терапии еще предстоит, наверное, немало постараться, чтобы довести эту технологию до того уровня эффективности, когда она сможет показывать убедительные результаты в испытаниях на животных и затем на людях. И лишь после этого можно будет говорить о возможности ее использования в клинической практике.
Если это удастся сделать, то мы сможем считать, что в организме человека больше нет такого гена, который мы не в силах изменить. И только тогда мы сможем надеяться, что человечество не вымрет.
С тех доисторических пор, когда люди начали заботиться о больных сородичах, естественный отбор перестал довлеть над Homo sapiens. А значит, патогенные мутации стали накапливаться. Это так называемое генетическое вырождение, которое может в конечном итоге привести к вымиранию. Есть два способа избежать такого конца: или вернуться к естественному отбору, то есть стать животными, или научиться исправлять генетические дефекты. Пока что мы все-таки идем по человеческому пути.